Niels Bohr se rappelle des résultats de Max Plank pour modéliser l’atome d’hydrogène. Le modèle se base sur la mécanique classique pour décrire le mouvement circulaire d’un électron autour du noyau. Son idée est d’introduire une règle de quantification du moment cinétique de l’électron…
If quantum mechanics hasn’t profoundly shocked you, you haven’t understood it yet.
Niels Bohr
Le modèle atomique de Bohr
Le modèle se base sur les considérations empiriques issues de l’étude des spectres d’émission décrits par la relation de Rydberg/Ritz, où E correspond à l’énergie du photon émis :
Avec ni et nf, les niveaux d’énergie initial et final, respectivement et RH la constante de Rydberg (1,0973732 107 m-1).
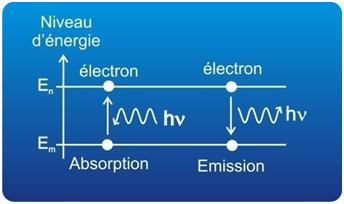
Figure 14. Transition électronique
Le modèle de Bohr (1913) est basé sur l’hypothèse de la quantification du moment cinétique orbital de l’électron qui ne peut prendre que des valeurs entières, positives non-nulles (valeurs dites quantifiées).
Dans cette représentation, les électrons se déplacent sur des orbites circulaires centrées sur le noyau (Figure 14). Toutes les orbites ayant le même rayon constituent une couche électronique (associées à un niveau d’énergie). Chaque couche (de rang n) ne peut recevoir que 2n2 électrons.

Figure 15. Représentation du modèle de Bohr de l'atome d'hydrogène. L'électron ne peut se déplacer que sur des niveau d'énergie quantifiés.
L’électron ne rayonne aucune énergie lorsqu’il se trouve sur une orbite stable (ou orbite stationnaire). Ces orbites stables sont différenciées, quantifiées. Ce sont les seules orbites sur lesquelles l’électron peut tourner (Figure 16).
L’électron ne rayonne ou n’absorbe de l’énergie que lors d’un changement d’orbite.
Pour commodité de lecture, les orbites possibles de l’électron sont représentées dans la littérature comme des cercles de diamètres quantifiés (Cette théorie est un modèle qui n’existe pas dans la réalité, il n’existe pas de position ni de vitesse précise d’un électron, et il ne peut donc parcourir un « cercle »; son orbitale peut en revanche être parfois sphérique).
Le spectre d’émission d’un atome correspond à l’émission de photons lors de la désexcetation de cet atome (Figure 16). Les radiations électromagnétiques associées aux photons émis résultent de transitions entre les couches d’énergie d’un niveau élevé (niveau ni) vers un niveau inférieur (nf). Les différentes transitions possibles de ni vers nf = 1, ni vers nf = 2 et ni vers nf = 3 définissent des domaines spectraux appelés respectivement séries de Lyman, Balmer et Paschen (Figure 17).
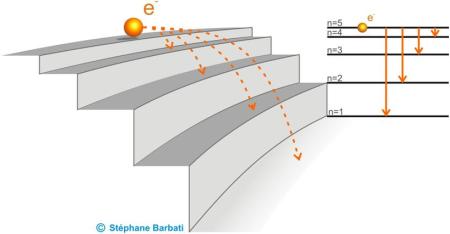
Figure 16. Illustration de transitions électroniques entre diférents niveaux d'énergie n.

Figure 17. Différents domaines des séries de transitions possibles d'un spectre d'émission (toutes les transitions ne sont pas représentées)
-
L’énergie est quantifiée, c’est à dire qu’elle ne peut prendre que certaines valeurs déterminées, appelées également niveau d’énergie.
-
À chacune des valeurs possibles pour l’énergie d’un électron correspond une trajectoire circulaire stable (sur laquelle l’électron ne rayonne pas et ne perd donc pas d’énergie), et une distance noyau-électron.
-
Les changements d’énergie d’un électron ne peuvent s’effectuer que par sauts discontinus d’un niveau à un autre. On appelle ces sauts des transitions électroniques.
-
En l’absence d’une excitation extérieure, un électron se trouve en permanence sur le niveau d’énergie le plus bas possible. Si tous les électrons d’un atome sont à leur niveau d’énergie le plus bas, on dit que l’atome est dans l’état fondamental. Sinon on dira qu’il est dans un état excité.
Question : quel est le domaine spectral d’émission de l’hydrogène ?
Anecdote :
« J’ai reçu un coup de fil d’un collègue à propos d’un étudiant. Il estimait qu’il devait lui donner un zéro à une question de physique, alors que l’étudiant réclamait un 20. Le professeur et l’étudiant se mirent d’accord pour choisir un arbitre impartial et je fus choisi. Je lus la question de l’examen :
Montrez comment il est possible de déterminer la hauteur d’un immeuble à l’aide d’un baromètre.
L’étudiant avait répondu : On prend le baromètre en haut de l’immeuble, on lui attache une corde, on le fait glisser jusqu’au sol, ensuite on le remonte et on calcule la longueur de la corde. La longueur de la corde donne la hauteur de l’immeuble.
L’étudiant avait raison vu qu’il avait répondu juste et complètement à la question. D’un autre côté, je ne pouvais pas lui mettre ses points : dans ce cas, il aurait reçu son grade de physique alors qu’il ne m’avait pas montré de connaissances en physique. J’ai proposé de donner une autre chance à l’étudiant en lui donnant six minutes pour répondre à la question avec l’avertissement que pour la réponse il devait utiliser ses connaissances en physique. Après cinq minutes, il n’avait encore rien écrit. Je lui ai demandé s’il voulait abandonner mais il répondit qu’il avait beaucoup de réponses pour ce problème et qu’il cherchait la meilleure d’entre elles. Je me suis excusé de l’avoir interrompu et lui ai demandé de continuer. Dans la minute qui suivit, il se hâta pour me répondre :
— On place le baromètre à la hauteur du toit. On le laisse tomber en mesurant son temps de chute avec un chronomètre. Ensuite en utilisant la formule : , on trouve la hauteur de l’immeuble.
À ce moment, j’ai demandé à mon collègue s’il voulait abandonner. Il me répondit par l’affirmative et donna presque 20 à l’étudiant. En quittant son bureau, j’ai rappelé l’étudiant car il avait dit qu’il avait plusieurs solutions à ce problème.
— Hé bien, dit-il, il y a plusieurs façons de calculer la hauteur d’un immeuble avec un baromètre. Par exemple, on le place dehors lorsqu’il y a du soleil. On calcule la hauteur du baromètre, la longueur de son ombre et la longueur de l’ombre de l’immeuble. Ensuite, avec un simple calcul de proportion, on trouve la hauteur de l’immeuble.
— Bien, lui répondis-je, et les autres.
— Il y a une méthode assez basique que vous allez apprécier. On monte les étages avec un baromètre et en même temps on marque la longueur du baromètre sur le mur. En comptant le nombre de traits, on a la hauteur de l’immeuble en longueur de baromètre. C’est une méthode très directe. Bien sûr, si vous voulez une méthode plus sophistiquée, vous pouvez pendre le baromètre à une corde, le faire balancer comme un pendule et déterminer la valeur de g au niveau de la rue et au niveau du toit. À partir de la différence de g la hauteur de l’immeuble peut être calculée. De la même façon, on l’attache à une grande corde et en étant sur le toit, on le laisse descendre jusqu’à peu près le niveau de la rue. On le fait balancer comme un pendule et on calcule la hauteur de l’immeuble à partir de la période de précession. Finalement, il conclut :
— Il y a encore d’autres façons de résoudre ce problème. Probablement la meilleure est d’aller au sous-sol, frapper à la porte du concierge et lui dire : « J’ai pour vous un superbe baromètre si vous me dites quelle est la hauteur de l’immeuble ».
J’ai ensuite demandé à l’étudiant s’il connaissait la réponse que j’attendais. Il a admis que oui mais qu’il en avait marre de l’université et des professeurs qui essayaient de lui apprendre comment il devait penser. »
Pour l’anecdote, l’étudiant était Niels Bohr (Prix Nobel Physique en 1922) et l’arbitre Ernest Rutherford (Prix Nobel Chimie en 1908). Les deux hommes ne se sont rencontrés qu’en 1912, pour diverses collaborations scientifiques. Bohr, à cette époque, n’était plus étudiant.


