Les aleurodes dans les cultures de serre : biologie, dommages et lutte
Renseignez-vous sur le cycle biologique, les dommages et les moyens de lutte associés aux aleurodes dans les cultures de serre.
Introduction
L'aleurode est un ennemi important des cultures de serre, dont les tomates, les concombres et de nombreuses espèces ornementales, comme le poinsettia, le gerbera et un certain nombre de cultures printanières. Bien des espèces de mauvaises herbes servent également d'hôtes à l'aleurode et deviennent souvent des sources d'infestations.
Description et cycle biologique
Les aleurodes adultes sont de petits insectes blancs et ailés, d'environ 1,5 à 2 mm de long (figures 1 et 2). La femelle pond ses œufs sur le revers des feuilles les plus jeunes. Les œufs sont trop petits pour être facilement repérables sans microscope (figures 3a et 3b). L'aleurode femelle peut pondre jusqu'à 300 œufs au cours de sa vie, qui dure jusqu'à 42 jours à 18 °C et 8 jours à 27 °C.

Figure 1. Aleurode des serres adulte.

Figure 2. Aleurode du genre Bemisia adulte.

Figure 3a. œufs qui viennent d'éclore (de couleur plus claire) et œuf éclos depuis plus longtemps (plus foncé).
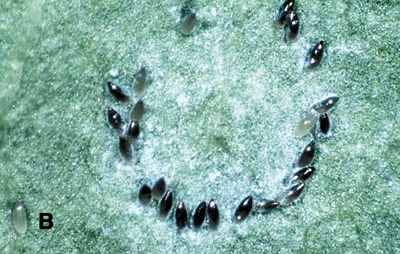
Figure 3b. œufs pondus en cercle sur certaines cultures par l'aleurode des serres.
Après l'éclosion, l'aleurode passe par quatre stades intermédiaires entre l'œuf et l'adulte. L'œuf met 5-10 jours pour éclore et donner ainsi lieu au premier stade larvaire (figure 4). À ce stade, les larves sont plates et ressemblent à des cochenilles. Elles sont mobiles pendant une courte période seulement. Les deuxième et troisième stades larvaires sont suivis d'un quatrième stade, celui de pupe. De la pupe émerge l'adulte (figures 5a et 5b). Il arrive qu'on trouve des coques de nymphose et des adultes sur le revers des feuilles inférieures, lesquelles peuvent présenter des symptômes de flétrissement.

Figure 4. Premier stade larvaire peu après l'éclosion des œufs.

Figure 5a. Pupe d'aleurode des serres.
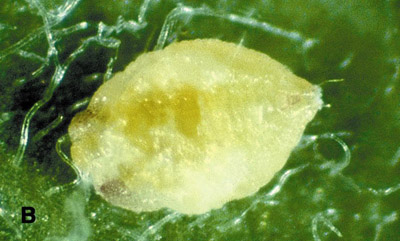
Figure 5b. Pupe d'aleurode du genre Bemisia.
En moyenne, les aleurodes complètent leur cycle biologique en 35 jours à 18 °C et en 18 jours à 30 °C. L'aleurode peut entrer en hivernation à tous les stades et peut généralement survivre tant qu'il y a quelque végétation dans son environnement.
Especes d'aleurode
Les espèces d'aleurodes préoccupantes pour les producteurs ontariens sont : l'aleurode des serres (Trialeurodes vaporariorum) (figure 1) et les aleurodes du genre Bemisia (figure 2). Ces dernières appartiennent à deux espèces : Bemisia tabaci, l'aleurode du tabac, et Bemisia argentifolii. Comme ces deux espèces sont difficiles à distinguer l'une de l'autre, dans la présente fiche technique, on les désigne comme étant les espèces du genre Bemisia.
Les adultes de l'aleurode des serres et des aleurodes du genre Bemisia se ressemblent beaucoup, mais ils présentent certaines différences. Les aleurodes du genre Bemisia sont légèrement plus petits que l'aleurode des serres et ils sont d'un jaune plus prononcé. Au repos, les aleurodes du genre Bemisia replient leurs ailes comme une tente au-dessus de leur corps, tandis que l'aleurode des serres garde ses ailes plus à plat et davantage parallèles aux surfaces sur lesquelles il se pose.
Les principales caractéristiques diagnostiques permettant de distinguer l'aleurode des serres et les aleurodes du genre Bemisia s'observent au stade de pupe. La pupe de l'aleurode des serres (figure 5a) semble flotter au-dessus de la surface de la feuille et est entourée d'une frange de poils, tandis que les pupes des aleurodes du genre Bemisia (figure 5b) se tiennent à plat sur la feuille et n'ont pas de frange. Ces caractéristiques s'observent mieux au microscope. Par ailleurs :
- les aleurodes du genre Bemisia volent d'une manière plus directe, tandis que l'aleurode des serres vole de façon plus désordonnée;
- les aleurodes du genre Bemisia ont un cycle biologique plus long;
- les aleurodes du genre Bemisia sont moins bien adaptés aux températures froides.
Dommages
Les aleurodes sont nuisibles pour les raisons suivantes :
- Ils ont des pièces buccales de type piqueur-suceur qui leur permettent d'aspirer la sève, ce qui affaiblit les plantes.
- Ils produisent en grande quantité une substance sucrée appelée miellat (figure 6a) qui favorise la formation de fumagine noire (figures 6b et 6c) à la surface des plantes. Même si la fumagine n'endommage pas directement les plantes, elle nuit à la photosynthèse et à la qualité de la culture.
- Ils peuvent transmettre des virus. Ainsi les aleurodes du genre Bemisia transmettraient plus de 60 virus et l'aleurode des serres contribuerait à la propagation du virus de la pseudo-jaunisse de la betterave (figure 7) chez les concombres.
- Dans les cultures ornementales, leur présence et leur grande visibilité ôtent de l'attrait aux plants (figure 8).

Figure 6a. Résidu de miellat sur une feuille de poinsettia.

Figure 6b. Fumagine sur un plant de tomate.

Figure 6c. Fumagine sur des plants de gerbera.

Figure 7. Virus de la pseudo-jaunisse de la betterave chez le concombre.

Figure 8. Des populations importantes d'aleurodes compromettent la qualité et les possibilités de commercialisation des cultures ornementales.
Stratégies de lutte
Recommandations générales
- Mettre en œuvre un programme de dépistage systématique prévoyant l'utilisation de plaquettes jaunes encollées ainsi que l'inspection périodique des plantes.
- Recourir aux plantes hôtes qui attirent davantage les aleurodes que la culture principale, comme outil de dépistage précoce ou comme plantes-pièges (p. ex., aubergine ou tabac).
- Marquer les plants infestés, afin qu'ils puissent servir d'indicateurs pour évaluer l'efficacité des méthodes de lutte.
- Intervenir rapidement dès qu'on observe des aleurodes adultes sur les plaquettes ou sur les feuilles terminales.
- Identifier l'espèce d'aleurode en cause.
- Maintenir une bonne lutte contre les mauvaises herbes.
- Dans le cas des cultures légumières infectées, mettre en quarantaine les nouveaux semis, les jeunes plants repiqués ou les boutures jusqu'à ce qu'il soit évident qu'ils sont exempts de virus.
Lutte biologique
On trouve actuellement sur le marché un certain nombre d'agents de lutte biologique efficaces contre les aleurodes :
- trois guêpes parasites : Encarsia formosa, Eretmocerus eremicus et Eretmocerus mundus,
- une petite coccinelle noire, Delphastus catalinae, et
- une punaise prédatrice, Dicyphus hesperus.
On trouve aussi sur le marché deux champignons parasites entomopathogènes, Beauveria bassiana et Isaria fumosorosea, qui ont pour hôtes les aleurodes.
Encarsia formosa
Encarsia est plus efficace contre l'aleurode des serres, mais permet aussi de lutter dans une certaine mesure contre les aleurodes du genre Bemisia. L'adulte mesure environ 0,6 mm de long; sa cage thoracique est noire et son abdomen jaune (figure 9a). Cette guêpe s'attaque aux aleurodes, principalement en pondant ses œufs dans les formes immatures (surtout les troisième et quatrième stades larvaires) de ces dernières. Au stade adulte, Encarsia formosa peut vivre de quelques jours à un mois selon la température. Les femelles pondent de 50 à 350 œufs au cours de leur vie.
Les pupes d'aleurodes des serres noircissent de 10 à 14 jours après avoir été parasitées (figure 9b). Il s'écoule en moyenne deux autres semaines avant que la guêpe adulte n'émerge. Lorsque celle-ci atteint la maturité, elle pratique une ouverture dans la partie supérieure de la pupe noire de l'aleurode avant de sortir.
Le parasitisme d'Encarsia n'est pas aussi efficace contre les aleurodes du genre Bemisia que contre l'aleurode des serres. Dans le cas des aleurodes du genre Bemisia , il est plus difficile de dire si la pupe est parasitée, car elle devient, non pas noire, mais de brun clair à brun foncé (figure 9c). Pour maîtriser les aleurodes du genre Bemisia avec Encarsia, envisager des taux d'introduction plus élevés du parasite.

Figure 9a. Encarsia formosa sous sa forme adulte.

Figure 9b. Pupe d'aleurode des serres parasitée par Encarsia formosa.

Figure 9c. Pupe d'aleurode du genre Bemisia parasitée par Encarsia formosa.
Voici des moyens d'améliorer l'efficacité d'Encarsia :
- Pendant au moins les trois mois qui précèdent les lâchers initiaux d'Encarsia, éviter d'utiliser des pesticides à longue rémanence. Pour des précisions relatives aux effets des pesticides sur les agents de lutte biologique, voir les sites de Biobest ou de Koppert, ou consulter un spécialiste de la lutte intégrée contre les ennemis des cultures de serre du MAAARO.
- Inspecter les cultures à tous les stades de croissance, afin de déceler les aleurodes et d'en suivre l'évolution des populations. Cette mesure permet de mieux planifier le moment et l'endroit où introduire les parasitoïdes.
- Introduire Encarsia au premier signe de la présence des aleurodes, ou, de manière préventive, avant leur apparition. Avant de faire des lâchers d'Encarsia, il peut être nécessaire de recourir à un pesticide de faible rémanence pour réduire les populations d'aleurodes s'ils sont déjà présents.
- Éviter d'avoir recours à Encarsia entre décembre et février, à moins de régler l'éclairage et la température en fonction des besoins du parasitoïde.
- Répartir les parasitoïdes dans les parties ombragées des plants, afin de les protéger de la lumière directe du soleil.
- Répartir les plaquettes de manière assez uniforme, en en plaçant toutefois davantage aux endroits où l'on a observé des aleurodes. Se procurer des plaquettes ayant moins de pupes parasitées par plaquette et poser plutôt davantage de plaquettes.
- Au moment de la taille ou de l'élagage, éviter d'enlever les feuilles où logent des larves immatures parasitées. L'élimination de ces feuilles ralentit la prolifération d'Encarsia et abaisse le taux de parasitisme.
- Poursuivre l'introduction d'Encarsia dans les cultures légumières jusqu'à ce qu'au moins 80 % des pupes sur les feuilles plus vieilles soient noires. Pendant les mois de grande chaleur, lorsque les aleurodes s'introduisent dans les serres depuis l'extérieur, les lâchers de parasites peuvent devoir être poursuivis ou augmentés.
Eretmocerus eremicus et Eretmocerus mundus
E. eremicus parasite à la fois l'aleurode des serres et les aleurodes du genre Bemisia, tandis qu'E. mundus est un parasite spécifique des aleurodes du genre Bemisia. L'adulte d'Eretmocerus a à peu près la même forme et la même grosseur qu'Encarsia, mais il est entièrement jaune (figure 10a). Bien que la guêpe de cette espèce puisse parasiter les quatre stades intermédiaires de l'aleurode, elle a une prédilection pour les deuxième et troisième stades. Les adultes vivent entre une et deux semaines et pondent une centaine d'œufs au cours de leur vie. Ils pondent la majorité de leurs œufs au cours des six premiers jours après leur sortie de la coque de nymphose. Puisque cette guêpe se développe à des températures plus élevées qu'Encarsia, il est préférable de la relâcher plus tard dans l'année, aux environs du mois de mars.
Les aleurodes parasités ont une teinte légèrement différente de celle de leurs congénères non parasitées, mais la différence n'est pas aussi nette que dans le cas d'Encarsia (figures 10b et 10c). Les moyens d'améliorer l'efficacité de ce parasitoïde sont semblables à ceux qui ont été énumérés pour Encarsia. Comme Eretmocerus est très attiré par les plaquettes et rubans jaunes encollés, il peut devenir nécessaire de réduire l'utilisation de ces outils lorsqu'on tente d'établir une population de cet auxiliaire de lutte.

Figure 10a. Adulte d'Eretmocerus eremicus.

Figure 10b. Pupe d'aleurode des serres parasitée par Eretmocerus.

Figure 10c. Pupe d'aleurode du genre Bemisia parasitée par Eretmocerus.
Delphastus catalinae
Les formes adulte (figure 11a) et larvaires (figure 11b) de Delphastus se nourrissent d'aleurodes, particulièrement d'œufs et de larves, Toutefois, elles évitent les pupes parasitées, un comportement qui rend leur utilisation compatible avec l'utilisation des guêpes parasites. On recommande d'utiliser ces coccinelles pour compléter l'activité des guêpes parasites contre les populations d'aleurodes. L'adulte de Delphastus vit de six à neuf semaines et doit apparemment consommer au moins 10 œufs d'aleurodes par jour pour réussir à se reproduire. Comme cette coccinelle a besoin d'un grand nombre d'aleurodes pour compléter son cycle biologique, elle convient davantage à des cultures offrant de plus grandes tolérances aux aleurodes, comme les cultures légumières ou la culture du gerbera destiné au marché des fleurs coupées.

Figure 11a. Adulte de Delphastus catalinae se nourrissant d'une larve d'aleurode.

Figure 11b. Larve de Delphastus catalinae.
Dicyphus hesperus
Dicyphus (figures 12a et 12b) est une punaise prédatrice dotée de pièces buccales de type piqueur-suceur. Cette punaise se nourrit d'un peu de tout, mais elle semble préférer les aleurodes, particulièrement ses œufs et ses formes larvaires. Elle se nourrit aussi, dans une moindre mesure, de pucerons, de tétranyques, de thrips, de larves de mineuses des feuilles et d'œufs de noctuelles. En l'absence de proies, une forte population de Dicyphus peut causer des dommages aux tomates et à des cultures florales, comme celle du gerbera. Dans la lutte contre les aleurodes, il est préférable d'utiliser Dicyphus conjointement avec les guêpes parasites Encarsia formosa et Eretmocerus eremicus. L'utilisation d'une plante-réservoir, comme la molène (Verbascum thapsus) (figure 12c), peut faciliter l'établissement de Dicyphus lorsque les populations d'aleurodes sont faibles.

Figure 12a. Dicyphus hesperus adulte.

Figure 12b. Adulte vert pâle de Dicyphus peu après son apparition.

Figure 12c. Plant de molène utilisé comme plante-réservoir dans une culture de tomate.
Lutte physique
La lutte physique contre les aleurodes prend les trois formes suivantes :
- Pièges encollés : des pièges jaunes encollés de formes variées peuvent être utilisés pour capturer un grand nombre d'aleurodes adultes. On utilise de grosses plaquettes jaunes encollées ou des rubans jaunes encollés de 30 cm dans les secteurs critiques. On peut aussi utiliser de grandes quantités de rubans jaunes encollés entre les poteaux le long des rangées de plants (figure 13). Ces pièges collants attirent aussi les thrips, les mouches des terreaux, les mouches des rivages et les guêpes parasites (surtout lorsque les populations d'aleurodes sont faibles).
- Captures par aspiration : l'aspiration manuelle des adultes dans les zones fortement infestées est très efficace pour éliminer rapidement les aleurodes adultes, mais est peu rentable dans les cultures occupant de grandes superficies (figures 14a et 14b).
- Barrières contre les insectes : la mise en place de fines moustiquaires sur les prises d'air et les portes réduit considérablement l'entrée des insectes dans les serres. À certaines périodes de l'année (p. ex., pendant les récoltes), lorsque les aleurodes arrivent en grand nombre des champs voisins (comme les champs de tomates), envisager de poser des moustiquaires comme première ligne de défense. Voir la fiche technique du MAAARO, Pose de moustiquaires pour exclure les insectes des serres.

Figure 13. Utilisation des rubans jaunes encollés pour le piégeage en masse.

Figure 14a. Aspiration manuelle des aleurodes adultes dans une culture de tomate.

Figure 14b. Aspiration manuelle des aleurodes adultes dans des plants de gerbera.
Lutte chimique
Les aleurodes peuvent développer une résistance à de nombreux pesticides. Une utilisation judicieuse de ces produits permettra d'y avoir recours plus longtemps et de retarder l'apparition d'une résistance. Toujours utiliser les pesticides parallèlement à un programme de dépistage prévoyant des seuils d'intervention, utiliser en alternance des produits appartenant à différents groupes chimiques et recourir à toutes les stratégies de lutte offertes.
Pour des précisions sur la lutte chimique, voir les publications du MAAARO 370F, Guide de la floriculture en serre, ou 835F, Guide de protection des légumes de serre.