Recommended
More Related Content
What's hot
What's hot (20)
Analytische chemie I - Hoofdstuk 2 - De zuur-base evenwichten

Analytische chemie I - Hoofdstuk 2 - De zuur-base evenwichten
Analytische chemie I - Hoofdstuk1 - Algemene Inleiding

Analytische chemie I - Hoofdstuk1 - Algemene Inleiding
Hoofdstuk 1 - Concentraties van Oplossingen - Deel 2

Hoofdstuk 1 - Concentraties van Oplossingen - Deel 2
Titratie van onbekende oplossing HCl met NaOH - molariteit

Titratie van onbekende oplossing HCl met NaOH - molariteit
Hoofdstuk 1 - Concentraties van Oplossingen - Deel 1

Hoofdstuk 1 - Concentraties van Oplossingen - Deel 1
Titratie van onbekende oplossing azijnzuur met NaOH - normaliteit

Titratie van onbekende oplossing azijnzuur met NaOH - normaliteit
Viewers also liked
Viewers also liked (11)
Titratie van onbekende oplossing HCl met NaOH - normaliteit

Titratie van onbekende oplossing HCl met NaOH - normaliteit
3 4 berekeningenvantitratiecurves&toepassingen_versie2015

3 4 berekeningenvantitratiecurves&toepassingen_versie2015
Oefeningen op pH-berekeningen van Polyzuren en polybasen

Oefeningen op pH-berekeningen van Polyzuren en polybasen
Dosage van natriumionen met behulp van een kationenwisselaar - normaliteit

Dosage van natriumionen met behulp van een kationenwisselaar - normaliteit
Dosage van natriumionen met behulp van een kationenwisselaar - molariteit

Dosage van natriumionen met behulp van een kationenwisselaar - molariteit
Titratie van onbekende oplossing azijnzuur met NaOH - molariteit

Titratie van onbekende oplossing azijnzuur met NaOH - molariteit
More from Tom Mortier
More from Tom Mortier (13)
Inleidende begrippen van de chemische thermodynamica

Inleidende begrippen van de chemische thermodynamica
Ppmenppbverdunningen
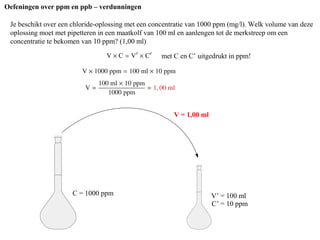
- 1. Oefeningen over ppm en ppb – verdunningen met C en C’ uitgedrukt in ppm! Je beschikt over een chloride-oplossing met een concentratie van 1000 ppm (mg/l). Welk volume van deze oplossing moet met pipetteren in een maatkolf van 100 ml en aanlengen tot de merkstreep om een concentratie te bekomen van 10 ppm? (1,00 ml) C = 1000 ppm C’ = 10 ppm V’ = 100 ml V = 1,00 ml
- 2. Oefeningen over ppm en ppb – verdunningen Je beschikt over een oplossing koperionen met een concentratie van 100 ppm (mg/l). Hiervan wordt een verdunning gemaakt door met een volumetrische pipet 3,00 ml over te brengen in een maatkolf van 100 ml en aan te lengen tot de merkstreep. De bekomen oplossing wordt verder verdund door met een volumetrische pipet 1,00 ml uit de vorige oplossing over te brengen in een maatkolf van 100 ml. Bereken na aanlengen en homogeen maken, de concentratie aan koperionen in de laatste oplossing uitgedrukt in ppb (µg/l). (30 ppb) C2 = ? V1 = 3,00 ml V2 = 100 ml Eerste verdunning C2 = ? V1 = 1,00 ml V2 = 100 ml Tweede verdunning
- 3. Oefeningen over ppm en ppb – verdunningen Er werd 60,0 mg vitamine C afgewogen op een analytische balans, opgelost en kwantitatief overgebracht in een maatkolf van 100 ml. Na aanlengen tot de merkstreep en homogeen maken van deze oplossing, werd hiervan 2,00 ml gepipetteerd in een maatkolfje van 25,0 ml. Bereken de concentratie aan vitamine C uitgedrukt in ppm (mg/l) in het maatkolfje van 25 ml na aanlengen en homogeen maken. (48 ppm) C1 in ppm of mg/l? V = 100 ml C2 = ? 60,0 mg vitamine C In 1000 ml O bevindt zich 0,600 g aspirine. In 1000 g O bevindt zich 0,600 g aspirine. We stellen dat 1,00 g O ≈ 1,00 ml O voor sterk verdunde oplossingen! In 1 000 000 g O bevindt zich 600 g aspirine. Dus: V1 = 2,00 ml V2 = 25 ml